 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie: tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie: tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
Chapitre X: Peroxydations lipidiques
1. Rappel sur l'insaturation lipidique
Le "squelette" des lipides naturels est constitué de longues chaînes carbonées (de 14 à 22 atomes de carbone) : les acides gras. Ces molécules peuvent présenter des doubles liaisons: elles sont alors insaturées. La fig. X-1 représente un des acides gras insaturés les plus abondants chez l'homme : l'acide linoléique.
![]()
Fig. X-1 : Acide linoléique. Le -CH2- central est le carbone le plus fréquemment
déshydrogéné par le processus de lipoperoxydation.
Dans les chaînes grasses non saturées à plus d'une double liaison (cas de la fig. X-1), il y a une alternance double liaison/2 liaisons simples (en rouge sur la fig. X-1). Sur les longues chaînes grasses de 20 et 22 carbones, on peut compter jusqu'à 6 doubles liaisons. Une manière fréquente de représenter les chaînes grasses est celle de la fig. X-2-A qui est plus évocatrice que la représentation linéaire et permet de mieux comprendre les processus de conjugaison. L'enlèvement d'un atome d'hydrogène peut se produire par l'intervention d'un radical libre tel que •OH produit par les radiations ionisantes ou par un oxoferryl et survient sur le carbone saturé près d'une double liaison (par exemple sur le C du –CH2- de la fig. X-1). La chaîne grasse devient radicalaire et subit un remaniement qui lui donne une structure conjuguée (fig. X-2 B).
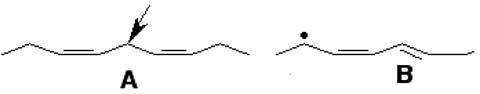
Fig. X-2 : A : Structure non conjuguée : les doubles liaisons sont séparées par 2 liaisons simples. La flèche indique l'endroit de la chaîne qui subira l'enlèvement d'un atome H•
B : Structure conjuguée : les doubles liaisons sont voisines. Le point figure l'électron célibataire.La structure conjuguée permet la résonance de l'électron célibataire et sa délocalisation (voir chapitre III) sur la distance de 5 carbones.
2. La peroxydation et ses étapes
Le rancissement des graisses est connu de longue date et a constitué un très gros problème de conservation des lipides tels que les huiles végétales et le beurre.
On reconnut des propriétés siccatives aux huiles insaturées, comme l'huile de lin. Les peintres de la Renaissance se servaient de cette dernière pour "sécher" leurs peintures. Ils entendaient par là un durcissement, une sorte de résinification de la surface peinte. On expliqua plus tard ce phénomène par des sortes de polymérisation unissant les molécules huileuses par le milieu de leurs chaînes. Ce durcissement s'opère par l'intervention de l'air.
Des processus semblables se produisent dans le vieillissement du caoutchouc qui perd ses propriétés élastiques, dans l'hyperviscosité des lubrifiants, etc. Nous verrons dans le chapitre XV comment, depuis l'Antiquité, les hommes ont cherché à protéger leurs produits contre des attaques venant de toute évidence de l'air.L'autoxydation des lipides
Les phénomènes décrits ci-dessus sont en rapport avec la présence de l'air. Dès le début du siècle dernier, des chimistes comme Moureu et Dufraisse étudièrent le phénomène et le définirent sous le nom d'autoxydation. L'autoxydation correspond à une fixation d'oxygène sur des molécules insaturées.
Mais il faut qu'au préalable un atome d'hydrogène soit enlevé sur la chaîne grasse, à proximité des doubles liaisons. Ce n'est pas l'oxygène qui est responsable de cette réaction initiant la peroxydation : Moureu et Dufraisse le reconnurent dans les années 20, bien avant que les règles de Wigner ne démontrent l'incapacité de O2 à réagir avec les singulets que constituent les lipides, saturés ou non (Moureu et coll., 1926).
Cette déshydrogénation a posé beaucoup de problèmes : il faut de l'énergie pour arracher un atome d'hydrogène. L'autoxydation d'un fût d'huile insaturée a été expliquée par la présence de chaînes à électron célibataire dans le mélange de lots ayant été exposés au soleil ou encore chauffés à une température de plus de 50°C. Des traces de métaux de transition peuvent intervenir. Dans le milieu hydrophobe qu'est l'huile, l'état radicalaire peut se conserver plus longtemps que dans une émulsion aqueuse.La fig. X-3 montre la succession d'événements aboutissant à la formation d'un hydroperoxyde : formation d'un radical libre dont la structure conjuguée permet la délocalisation de l'électron célibataire et retarde la dimérisation. La persistance (très relative !) de l'état radicalaire permet, en milieu aérobie, la rencontre avec une molécule •OO• et la formation d'un radical peroxyle, capable d'enlever un atome d'hydrogène à une nouvelle molécule lipidique : des réactions en chaîne s'amorcent (voir chapitre III).
L'atome H• s'unissant au radical peroxyle (Fig. X-3, réaction 4) a été enlevé à une autre chaîne (réaction 1) avec formation d'un nouveau radical libre qui va subir à son tour les réactions 2 à 4 : une réaction en chaîne a donc lieu.
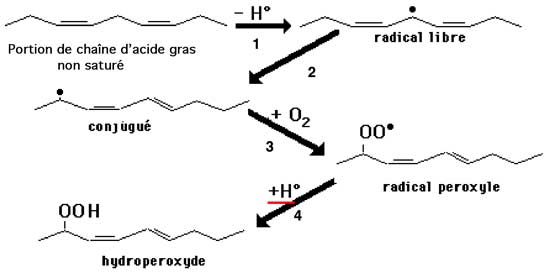
Fig. X-3 : Peroxydation d'une portion de chaîne correspondant à celle imprimée en rouge de la fig. IX-1.
Dans les milieux lipidiques, l'extension de l'autoxydation est très lente au départ. Mais une fois déclenchée, elle suivra un processus exponentiel. En milieux aqueux (émulsions), le processus peut être considérablement accéléré par des traces de métaux complexés (fig. X-4).
3. Cycles d'autoxydation lipidique
Dans les équations suivantes, RH représente des molécules lipidiques poly-insaturées qui entrent dans une chaîne cyclique de peroxydations
a) Initiation par deshydrogénation (fig. X-4 encadré bleu)
RH + X• ---> R• + XHb) Propagation par présence de O2 : (fig. X-4 encadré rouge)
R• + •O-O• ---> ROO•
et par le radical perhydroxyle formé, qui joue à son tour le rôle de XH:
ROO• + RH ---> ROOH + R•c) Terminaison par dimérisation de R• (fig. X-4 encadré vert)
d) Extension : Les hydroperoxydes ROOH peuvent également devenir des radicaux RO• (alkoxyls) en présence d'un métal de transition réduit, comme le fer, le cuivre, le cobalt, etc ( fig. X-4 hors cadres)
ROOH + L-Fe2+ ---> RO• + OH- + L-Fe3+e) Relance du cycle de l'encadré rouge
RO• + RH ---> ROH + R•
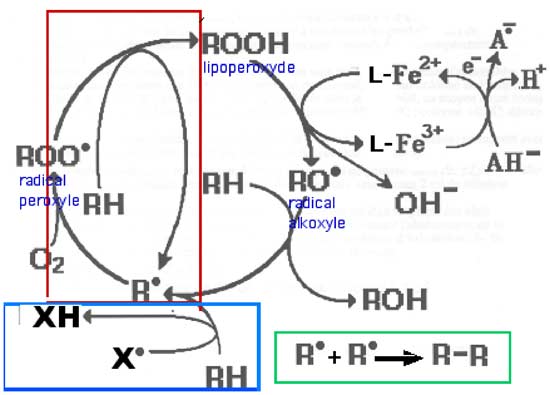
Fig. X-4 : Cycle d'autoxydation d'un lipide insaturé RH.
Encadré bleu : phase d'initiation.
Encadré rouge : phase de propagation constituant le cycle proprement dit.
Encadré vert : phase de terminaison par dimérisation de deux radicaux R•
Hors encadré : Rôle des métaux de transition dans la genèse des radicaux alkoxyles RO•.
Remarques
a) Soulignons l'importance d'adjuvants tel que l'ascorbate AH- qui réduit le métal oxydé (Fe3+) lui permettant de participer à une nouvelle attaque de lipoperoxyde. Souvent la durée du phénomène dépend de la consommation totale du réducteur.
b) Les alkoxyles RO• sont d'efficaces initiateurs de cycles d'autoxydation.4. Oxydation des lipoprotéines
a. Structure des lipoprotéines
Les lipides, malgré l'insolubilité de la plupart d'entre eux dans les milieux aqueux, circulent dans le sang grâce à des édifices complexes, les lipoprotéines. Les lipoprotéines constituent un domaine très important des lipides biologiques, car elles permettent le transport dans le plasma (milieu aqueux) de molécules grasses essentielles (acides gras poly-insaturés des familles ω-3 et ω-6, des vitamines liposolubles, etc …).
On attribue à certaines lipoprotéines l'origine d'une des affections mortelles les plus répandues dans le monde : l'athérosclérose dont il sera question de manière détaillée dans le deuxième tome de cette initiation: L'oxygène en pathologie des mammifères.
Une lipoprotéine est constituée par une microgouttelette d'un mélange de lipides non polaires (esters de cholestérol et triglycérides), entourée par une enveloppe formée d'une couche monomoléculaire de molécules amphiphiles (ayant simultanément des affinités pour l'eau et pour les molécules non chargées électriquement) : une des extrémités de ces composés est ionisable, donc hydrosoluble, tandis que l'autre n'est soluble que dans les milieux non aqueux (Fig. X-5).
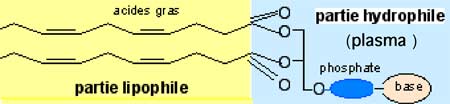
Fig. X-5 : Type de molécule amphiphile : molécule de phospholipide.
Les molécules amphiphiles forment une écorce entourant la partie grasse de la lipoprotéine, les pôles hydrophiles étant orientés vers l'extérieur (le plasma où l'eau domine) et les pôles lipophiles plongeant dans les lipides du noyau graisseux (fig. X-6). Cette couche amphiphile est formée de phospholipides (bipolaires), de cholestérol et de protéines classées en 4 types (Apo-A, Apo-B, Apo-C et Apo-E). Nous n'irons pas plus loin concernant ces macromolécules (fig. X-6).
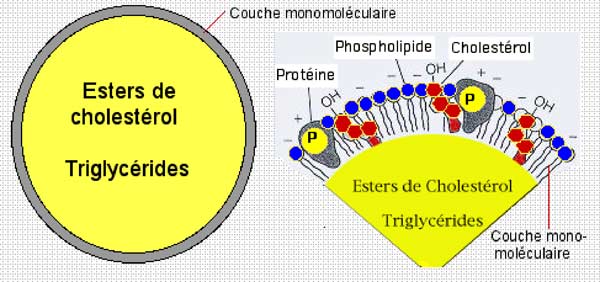
| Fig. X-6 : A gauche : un schéma général de la structure sphérique des lipoprotéines dont le diamètre varie entre 10 nanomètres (HDL) et 20 nanomètres (LDL). A droite : une coupe idéale de la couche monomoléculaire qui est formée de molécules polarisées dont les charges électriques (positives ou négatives) sont orientées vers le milieu aqueux (généralement le sang) permettant l'association de ces pôles avec des molécules d'eau. La partie apolaire de ces molécules est orientée vers l'intérieur où elle baigne dans le milieu lipidique. |
b. Les formes oxydées du cholestérol
Le cholestérol abonde dans les membranes cellulaires et dans les lipoprotéines sanguines, sous forme libre ou estérifiée. Divers ROS peuvent oxyder le cholestérol (libre ou estérifié) en donnant une série d'oxystérols. Ces ROS, dans la nature, peuvent être des hypochlorites générés par la myéloperoxydase. L'ozone peut oxyder le cholestérol et ses esters constituant le surfactant pulmonaire. Les oxystérols ont des propriétés physiologiques (régulations) et toxicologiques importantes (intervention dans l'athérosclérose) qui seront traitées dans le second tome de cette initiation. La fig. X-7 montre la numérotation des atomes de carbones constitutifs du cholestérol et permet de situer le lieu où cette molécule est oxydée. Nous donnons sur la fig. X-8 quelques exemples d'oxydation du cholestérol observés dans des échantillons biologiques.
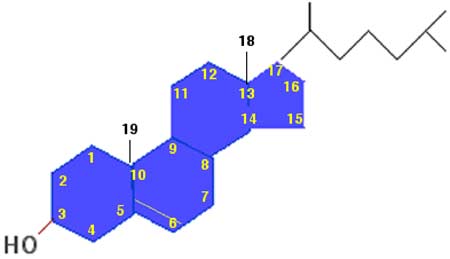
Fig. X-7 : Molécule de cholestérol et numérotation des carbones.
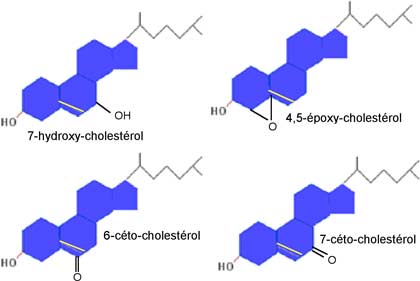
Fig. X-8 : Quelques dérivés oxydés du cholestérol; le 7-cétocholestérol et le 7-hydroxycholestérol
sont particulièrement incriminés dans la maladie athéroscléreuse.
c. Complexité de l'oxydation des lipoprotéines
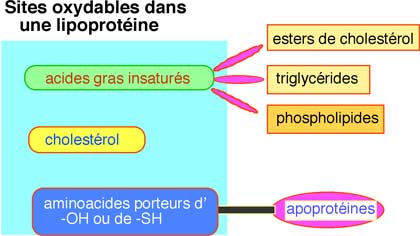
Fig. X-9 : Les 4 sites d'une lipoprotéine susceptibles d'être attaqués par un ROS.
Nous n'avons actuellement aucune preuve nous permettant d'assurer que, dans le sang humain par exemple, l'oxydation et la peroxydation des divers sites se produisent selon un mécanisme bien déterminé. Or, actuellement, la présence de lipoprotéines oxydées dans le sang est considérée comme un facteur prédictif ou diagnostique de l’athérosclérose. Les techniques utilisées pour la mesure des lipoprotéines oxydées dans le sang sont des procédés immunologiques qui utilisent des anticorps dirigés contre des lipoprotéines oxydées in vitro (artificiellement) par des réactions chimiques (le plus souvent en présence de Cu2+). Ces anticorps reconnaissent un mélange de formes oxydées des lipoprotéines dont il n’est pas prouvé qu’elles correspondent aux formes oxydées réellement produites in vivo. Nous pensons donc que ces méthodes d'analyse ne peuvent fournir que des résultats qualitatifs.
5. Voies de décomposition des lipoperoxydes
Un acide gras peroxydé subit des ruptures de chaînes donnant naissance à divers composés dont les plus intéressants du point de vue pathologique sont les aldéhydes, considérés comme toxiques.
Fig. X-10a : Rupture d'un radical alcoxyle. Les flèches rouges indiquent les endroits possibles de cassure de la chaîne.
Le schéma figurant ici représente le résultat d'une rupture survenue au niveau indiqué par la flèche de droite.
Fig. X-10b : 2,4-hydroxynonénal
Parmi les divers aldéhydes qui peuvent se former, le 2,4-hydroxynonénal a été particulièrement étudié du point de vue toxicologique (fig. X-10b). Les actions physiologiques et pathologiques des aldéhydes seront étudiées dans le deuxième tome L'oxygène en pathologie des mammifères.6. Possibilités de lipoperoxydations in vivo
a) Via des réactions mettant en jeu des ions ferryles tels que les dérivés de l'hémoglobine
Nous avons vu au chapitre IX , fig.IX-12, le schéma général de fonctionnement d'une peroxydase. L'hémoglobine peut subir un processus d'autoxydation en devenant de la methémoglobine. Il en est de même pour la myoglobine (metmyoglobine). L'effet catalytique des hèmes sur la peroxydation des acides gras polyèniques a été mentionné pour la première fois par Robinson et al. en 1924. Le rôle de cette réaction sur la rancidité oxydative des graisses a fait l'objet de nombreux travaux par la suite.
La séparation de l'hème d'avec la globine accroît d'un facteur 22 son activité catalytique de peroxydation. La catalyse "haem-mediated" est donc indépendante du fait que certains hèmes sont des enzymes (Tappel, 1961). L'environnement hydrophobique de la poche hémique favorise l'approche du fer hémique par les molécules lipidiques, tout en limitant leur nombre (Tappel, 1961). La fig. X-11 étudie le rôle de l'hème oxydé au stade FeIII associé à une globine (hémoglobine ou myoglobine) désignée par metglobine. Mais il est certain que l'association avec la globine, si elle diminue la vitesse de peroxydation, favorise le contact avec les molécules grasses et, in vivo, protège l'hème d'une destruction rapide (voir chapitre XV, hème oxygénase).
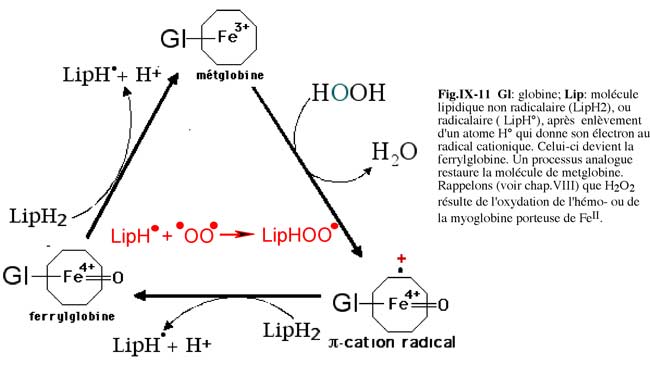
b) via des voies enzymatiques
Nous étudions, dans le chapitre XIII, les enzymes directement impliquées dans la synthèse d'hydroperoxydes : les PG synthases et les lipoxygénases.
c) Le problème de la détection des lipoperoxydes
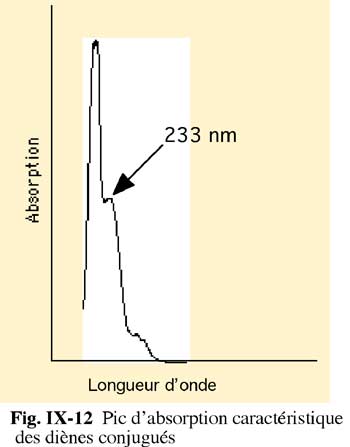
Technique des diènes conjugués
La peroxydation des acides gras non saturés provoque la conjugaison des doubles liaisons (voir fig. X-3): formation de diènes conjugués relativement stables qui peuvent être mesurés en spectrophotométrie à 233 nm (fig. X-12). Avec l'augmentation de sensibilité des spectrophotomètres actuels, cette technique semble une des plus fiables pour la mesure finale de la peroxydation lipidique. Il est évident que d'autres structures conjuguées peuvent interférer et doivent être identifiées.Recherche de la malondialdéhyde
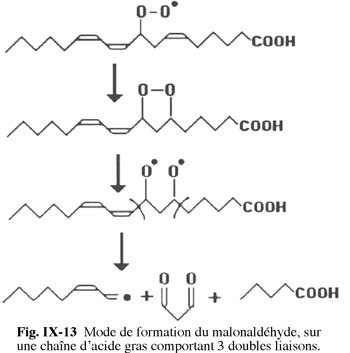
Fig. X-14 : Acide thiobarbiturique (TBA)Ce procédé, qui date de la fin des années 1940, est le plus employé jusqu'à présent. Il consiste à faire réagir l'acide thiobarbiturique (fig. X-14), TBA, avec la malonaldéhyde produite par décomposition des lipoperoxydes selon la réaction de la figure X-13 et aboutit à la formation d'un chromophore rouge.
Cette méthode a subi de nombreuses critiques :
1. selon Dahle (1962), la malonaldéhyde ne se formerait qu'à partir de chaînes d'acides gras ayant au moins 3 doubles liaisons comme l'acide linolénique, ce qui excluerait les peroxydes de l'acide linoléique et oléique.
2. l'un des défenseurs les plus acharnés de la méthode à la TBA, B Halliwell (1981), a reconnu que ce chromogène peut réagir avec des composés très différents des lipoperoxydes comme les dérivés de l'acide désoxyribonucléique. Il introduisit le concept de "TBA-reactants" (TBARs), affirmant toutefois que la présence de TBARs dans les liquides organiques (sang, lymphe, etc …) signait l'existence d'un processus dégénératif lié aux "stress oxydant".
3. Pyles et coll (1993) ont montré les interférences survenant dans le sang et le plasma et dues à la présence d'hémoglobine libre dont il faut calculer la participation, ce qui ne semble pas aisé.
Nous concluons que, malgré sa popularité, cette méthode n'apparaît pas utilisable universellement et nous semble réservée à des études in vitro dans des conditions chimiques très précises.Recherche des aldéhydes
Il est bien établi que des aldéhydes se forment par décomposition des lipoperoxydes, tels que le 4-hydroxy-nonénal, etc ... En utilisant un chromatographe en phase gazeuse muni d'une détection NPD (nitrogen phophorus detection), on peut mesurer tous les aldéhydes présents dans un échantillon avec leur identification; on peut aussi utiliser la chromatographie gazeuse couplée à un spectromètre de masse (Thomas et coll., 1995). Ces méthodes nous semblent être les techniques d'avenir.Technique de mesure du pentane
C'est à la fin des années 1970 que Tappel proposa la mesure du pentane dégagé par les acides gras peroxydés et que l'on pourrait mesurer dans les gaz expirés. Kivits et coll (1981) montrèrent que, selon le nombre de doubles liaisons, outre le pentane, de l'éthane, du propane et de l'hexane pouvaient aussi se former. De nombreuses publications suivirent (Kunert et Tappel, 1983; Filser et coll., 1983). En 1986, Deby et coll. ont montré que le pentane peut être oxydé en pentanol par les microsomes hépatiques, ce qui laisse supposer qu'une partie seulement du pentane créé dans un organisme arriverait dans les poumons, et ce d'une manière dépendante de l'activité des cytochromes P450. La méthode utilisant le pentane nous semble utile pour suivre la peroxydation in vitro dans des systèmes précis, dépourvus d'agents capables d'oxyder le pentane.Technique à l'éthylène
Différents composés soufrés tels que la méthionine et le méthional sont connus pour être facilement oxydés en dégageant de l'éthylène. Klebanoff et Rosen (1978) ont standardisé cette méthode en utilisant l'acide 2-keto-4-thiométhylbutyrique (KMB ou KTBA). Cette méthode est utile pour mettre en évidence in vitro l'apparition de ROS. Tant les ions ferryles (Harel et Kanner, 1988) que les radicaux hydroxyles générés par radiolyse et les radicaux alcoxyles et peroxyles provoquent la décomposition du KMB avec un dégagement d'éthylène facile à mesurer en chromatographie en phase gazeuse.Usage de la résonance paramagnétique électronique
Les nombreux passages par l'état radicalaire au cours de l'oxydation des lipides non saturés impliquent l'apparition de signaux en RPE. Toutefois, cette méthode est surtout qualitative. La mise en évidence directe d'un peroxyde lipidique demande l'observation à une température inférieure à –140°C. En pratique, la réaction de peroxydation est gelée par immersion du système dans l'azote liquide (-273°C). Une technique, basée sur l'utilisation de piégeurs de spin (spin-traps), permet de travailler à température ordinaire. Le lecteur est invité à consulter les articles spécialisés (par exemple: Mouithys-Mickalad et coll., 2002).Que penser des techniques de mesure de la lipoperoxydation ?
Les diverses méthodes apparaissent relativement fiables lorsqu'on étudie les phénomènes de peroxydations dans des conditions in vitro chimiquement très bien définies, avec des réactifs très purs. Elles permettent alors une étude précise des cinétiques chimiques des réactions de peroxydation. Lorsque ces techniques sont appliquées aux échantillons d'origine biologique, la complexité de ceux-ci amènera forcément des artéfacts. On peut cependant tirer parti des différents procédés énumérés en appliquant simultanément plusieurs techniques à un même échantillon, ce qui permet de constater s'il y a convergence des résultats (Buege et Aust, 1978). Il nous semble que, parmi ces combinaisons de technique, devrait figurer le plus souvent possible la technique des diènes conjugués et qu'il faudrait développer le procédé chromatographique de détection NPD des aldéhydes.
7. Bibliographie
Généralités
Consulter : Peroxyl Radicals, ZB Alfassi, ed., John Wiley & Sons, New York, 1997, 535 pages.
Moureu C, Dufraisse C, Dean PM. Comptes Rendus de l'Académie des Sciences (Paris). 1926; 182: 1584-1586.
Tappel AL, Brown WD, Zalkin H, Maier VP. Unsaturated lipid peroxidation catalyzed by hematin compounds and its inhibition by vitamin E. Journal of American Oil Chemist's Society. 1961; 38: 3-9.
Comporti M. Lipid peroxidation : an overview. In: Free radicals, from basic science to medicine. G Poli, E Albano, MU Dianzani, eds, Birkhaüser Verlag, Basel Boston Berlin, 1993, pp.65-79.
Minotti G., Aust SD. Redox cycling of iron and lipid peroxidation. Lipids. 1992; 27: 219-226.
Schaich KM. Metals and lipid oxidation. Contemporary issues. Lipids. 1992; 27: 209-18. Review.Oxydation des lipoprotéines
Meaney S, Hassan M, Sakinis A, Lutjohann D, von Bergmann K, Wennmalm A, Diczfalusy U, Bjorkhem I. Evidence that the major oxysterols in human circulation originate from distinct pools of cholesterol: a stable isotope study. Journal of Lipid Research. 2001; 42: 70-8.
Schroepfer GJ Jr. Oxysterols: modulators of cholesterol metabolism and other processes. Physiological Review. 2000; 80: 361-554. Review.Problèmes techniques
Buege JA, Aust SD. Microsomal lipid peroxidation. Methods in Enzymology. 1978; 52: 302-310.
Dahle LK, Hill EG, Holman RT. The thiobarbituric acid reaction and the autoxidations of polyunsaturated fatty acid methyl esters. Archives of Biochemistry and Biophysics. 1962; 98: 253-61.
Halliwell B, Gutteridge JM. Formation of thiobarbituric-acid-reactive substance from deoxyribose in the presence of iron salts: the role of superoxide and hydroxyl radicals. FEBS Letters. 1981; 128: 347-52.
Pyles LA, Stejskal EJ, Einzig S. Spectrophotometric measurement of plasma 2-thiobarbituric acid-reactive substances in the presence of hemoglobin and bilirubin interference. Proceedings of the Society for Experimental Biology and Medicine. 1993; 202: 407-419.
Klebanoff SJ, Rosen H. Ethylene formation by polymorphonuclear leukocytes. Role of myeloperoxidase. Journal of Experimental Medicine. 1978; 148: 490-506.
Harel S, Kanner J. The generation of ferryl or hydroxyl radicals during interaction of haemproteins with hydrogen peroxide. Free Radical Research Communications. 1988;, 5: 21-33
Tappel AL, Dillard CJ. In vivo lipid peroxidation: measurement via exhaled pentane and protection by vitamin E. Federation Proceedings. 1981; 40: 174-8.
Kunert KJ, Tappel AL. The effect of vitamin C on in vivo lipid peroxidation in guinea pigs as measured by pentane and ethane production. Lipids. 1983; 18: 271-4.
Filser JG, Bolt HM, Muliawan H, Kappus H. Quantitative evaluation of ethane and n-pentane as indicators of lipid peroxidation in vivo. Archives of Toxicology. 1983; 52: 135-47.
Kivits GA, Ganguli-Swarttouw MA, Christ EJ. The composition of alkanes in exhaled air of rats as a result of lipid peroxidation in vivo. Effects of dietary fatty acids, vitamin E and selenium. Biochimica Biophysica Acta. 1981; 665: 559-70.
Deby C, Pincemail J, Bertrand Y, Lismonde M, Lamy M, Goutier R. Consumption of pentane by hepatic microsomes and consequences on pentane measurement in exhaled gases. Archives Internationales de Physiologie et de Biochimie. 1986; 94: S19-21.
Thomas MJ, Robison TW, Samuel M, Forman HJ. Detecting and identifying volatile aldehydes as dinitrophenylhydrazones using gas chromatography mass spectrometry. Free Radicals in Biology and Medicine. 1995; 18: 553-7.
Mouithys-Mickalad A, Mathy-Hartert M, Du G, Sluse F, Deby C, Lamy M, Deby-Dupont G. Oxygen consumption and electron spin resonance studies of free radical production by alveolar cells exposed to anoxia: inhibiting effects of the antibiotic ceftazidime. Redox Report 2002; 7: 85-94.